Unidad 1, Clase 6: Proteinas y enzimas
Autor: Camilo Meza Gaete
Contacto: [email protected]
Proteínas
Las proteínas son macromoléculas que se traducen a partir de un gen, y tienen actividad biológica.
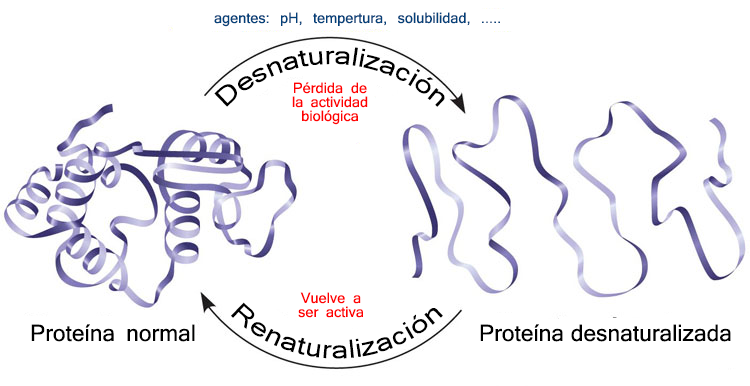
Las proteínas poseen una estructura tridimensional, corresponde a su estructura más estable y es la que será funcionalmente activa.
El ambiente celular es el que regula la activación o desactivación de la estructura nativa.
Las proteínas pueden perder esta forma activa (proceso que se conoce como desnaturalización) en presencia de determinados factores como cambios de pH, temperatura o agentes químicos (urea, etanol, etc.)
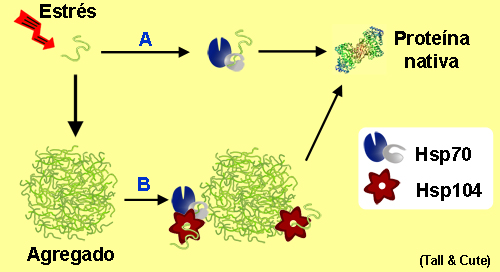
La información de la función de una proteína está contenida en su secuencia de aminoácidos. Pero esa molécula lineal que se produce en el ribosoma, debe plegarse antes para poder realizar esa función. Aunque la información de ese plegamiento depende de la propia secuencia, se necesitan otras proteínas , las chaperonas, para ello.
Estructura de una proteína
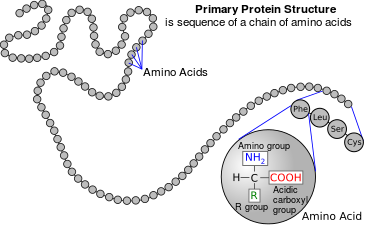
Estructura primaria:
Es la secuencia de aminoácidos en la proteína.
Determinará los plegamientos posteriores y la estructura nativa de la proteína.
Estructura secundaria:
Corresponde a los plegamientos que sufre la estructura primaria, pueden ser hélices alfa o láminas beta.
Hélice alfa:
Láminas beta:
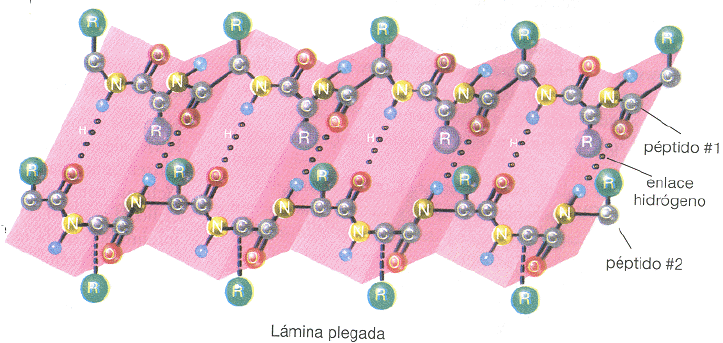
Estructura terciaria:
Corresponde a la estructura tridimensional de la proteína.
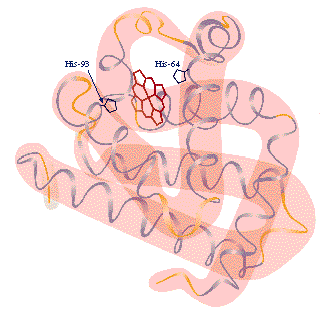
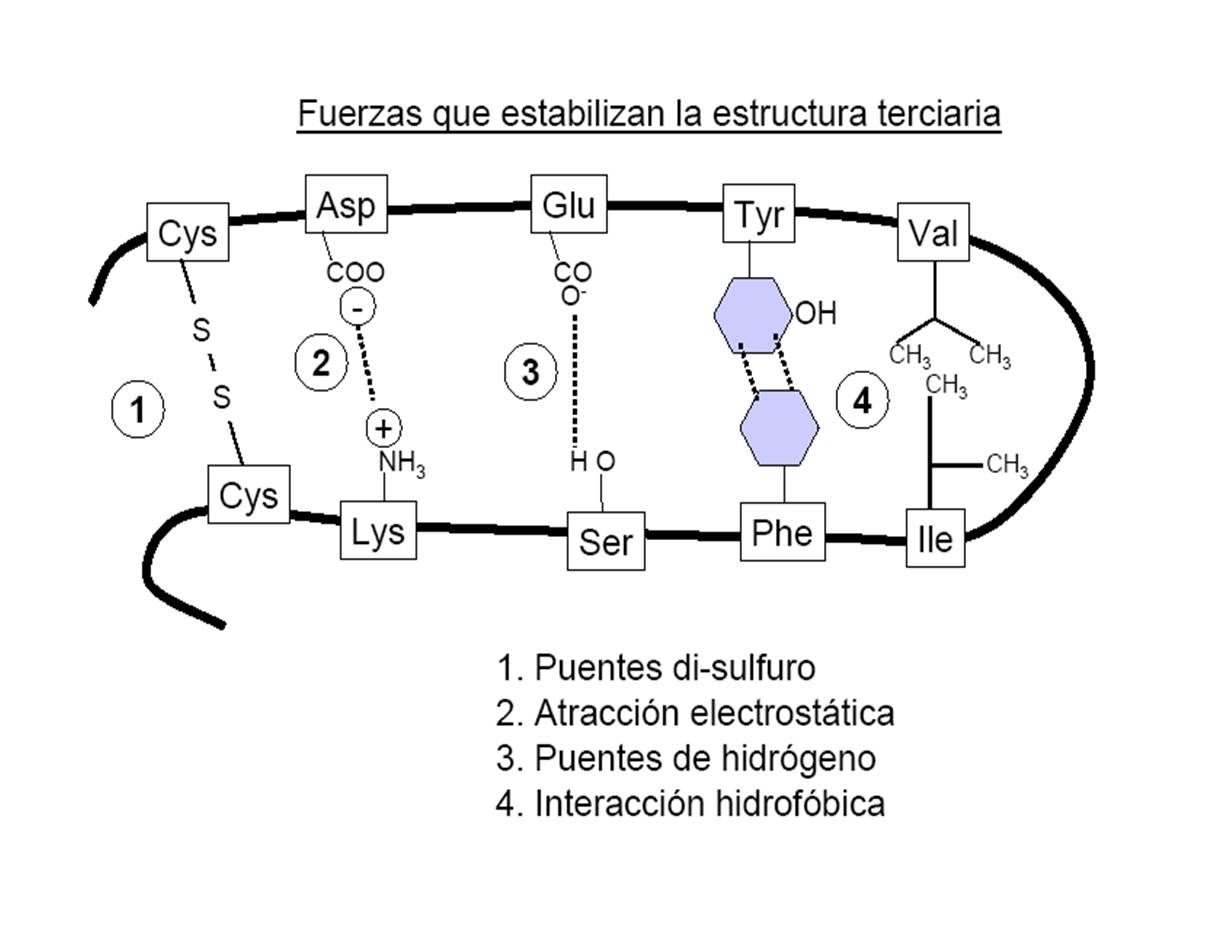
Se estabiliza por interacciones intramoleculáres:
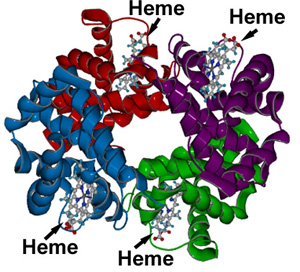
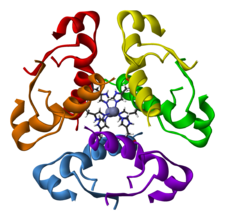
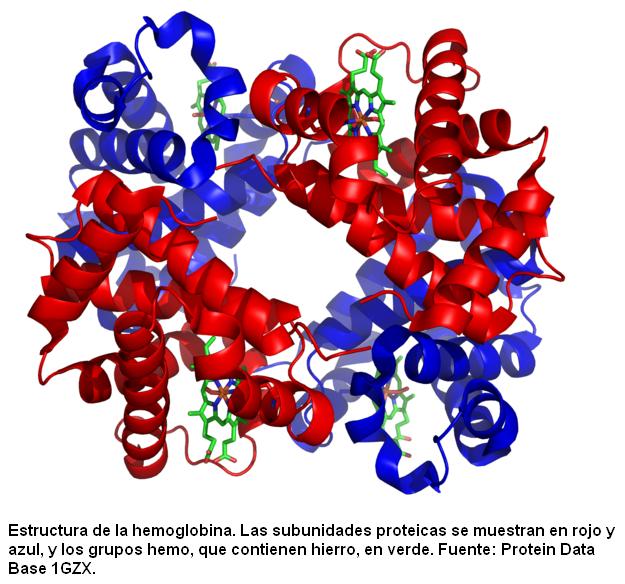
Estructura cuaternaria:
Es el tipo de nivel estructural que se aprecia cuando varias proteínas trabajan en conjunto obteniendo así su función biológica.
Enzimas
Una enzima es una proteína que hace que una reacción química energéticamente posible pero que transcurre a una velocidad muy baja, transcurra a mayor velocidad. A las reacciones mediadas por enzimas se las denomina reacciones enzimáticas.
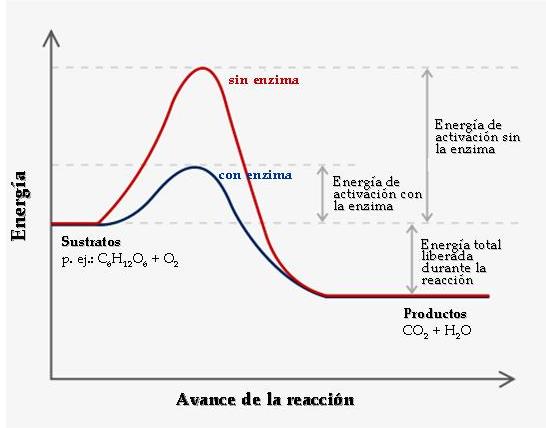
Aceleran las reacciones metabólicas entre 10⁷ y 10¹⁴ veces (más eficientes que los catalizadores no biológicos).
No se consumen durante las reacciones que catalizan.
Poseen un sitio activo que es altamente específico para un sustrato.
Sitio activo:
Es el sitio en el cual el o los sustratos se unen a la enzima. En general estos sitios se encuentran en el interior de la estructura protéica, formando hendiduras o bolsas, de manera que el sustrato pueda experimentar un máximo de interacciones con la enzima.
De toda la estructura de la enzima, que en realidad son moléculas enormes, solo una parte muy pequeña interactúa con el sustrato; en general solo p articipan cinco o seis aminoácidos.
Cinética enzimática:
Es el estudio de la unión entre la Enzima y el sustrato.
Se puede entender en dos pasos:
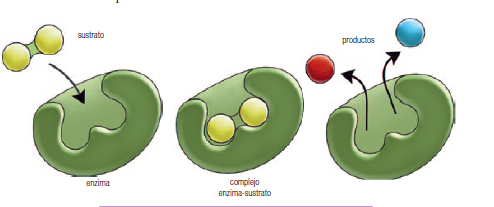
El sustrato (S) y la Enzima (E) se unen de forma reversible, formando así el complejo Enzima-Sustrato (ES)
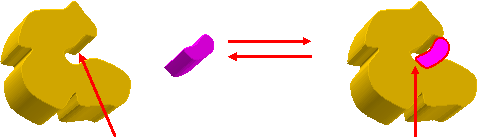
El complejo Enzima-Sustrato (ES) da lugar a la formación del Producto (P) y la Enzima se libera.
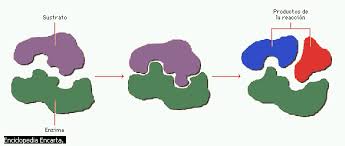
Mecanismos de acción enzimática:
Existen dos modelos que permiten explicar cómo se logra la acción enzimática:
- El modelo de llave-cerradura
- El modelo del encaje inducido
Modelo llave-cerradura: el sustrato se une de forma exacta al sitio activo de la enzima. Las conformaciones de los sitios de unión de cada molécula son complementarias.
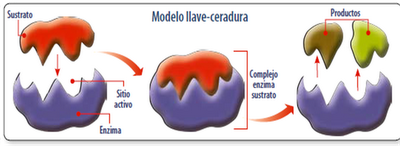
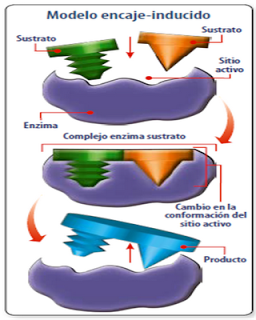
Modelo de encaje inducido: es el modelo más aceptado. Sugiere que el sustrato correcto es capaz de inducir un cambio de conformación del sitio activo de la enzima para que esta realice su función catalítica.
En otras palabras, el sitio activo de la enzima se adapta al sustrato sustrato hasta que ambos (E y S) están completamente unidos.
La enzima es una molécula flexible que se adecúa al sustrato.
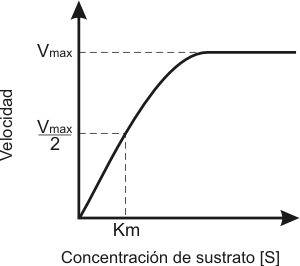
Ecuación de Michaelis-Menten:
Es un modelo matemático que predice la velocidad de reacción de muchas reacciones enzimáticas conociendo las concentraciones de las moléculas que reaccionan (E y S). Aplicable a reacciones enzimáticas donde: [S] > [E] [ES] permanece constante.
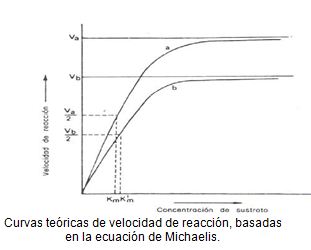
Esto sería un ejemplo de estudio para un par de enzimas respecto de la concentración de sustrato:
Factores que afectan la actividad enzimática:
Concentración del sustrato:
Si se mantiene constante la concentración de la enzima, AUMENTA exponencialmente la velocidad de la reacción si aumenta la concentración del sustrato.
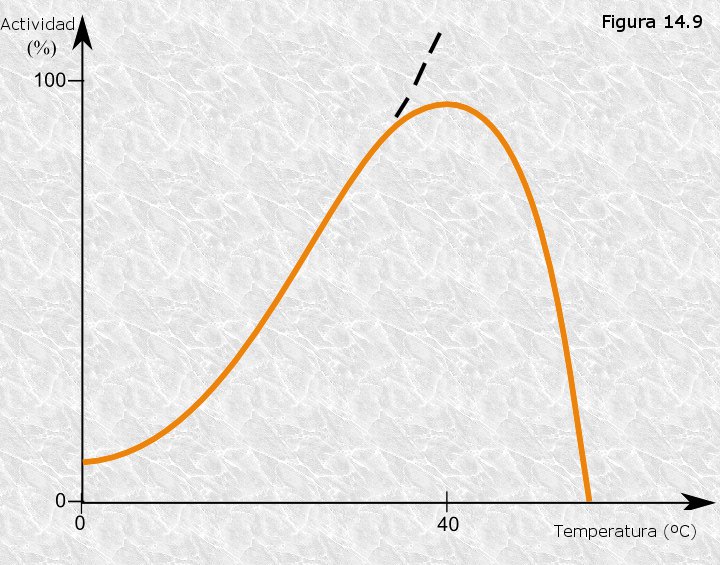
Temperatura:
Para cada enzima existe un rango de temperatura de reacción, en la mayoría de las reacciones químicas la velocidad de las reacciones enzimáticas se incrementa al aumentar la temperatura (aumenta la energía cinética de las moléculas).
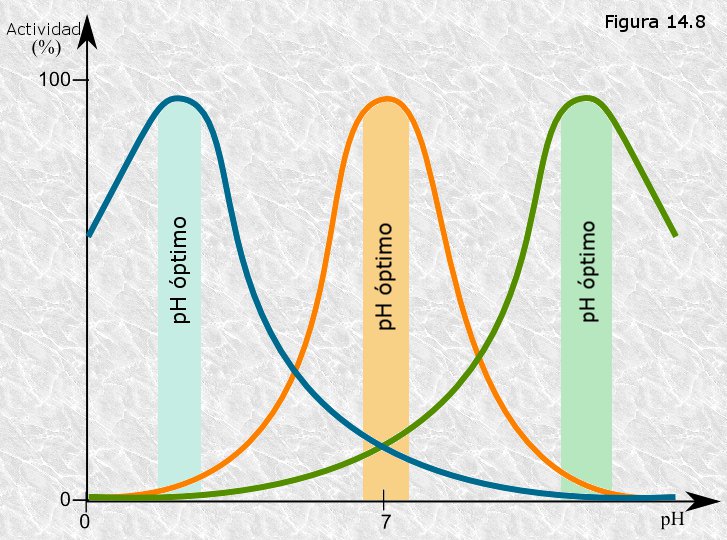
pH:
Pada enzima cataliza una reacción en un margen de pH determinado. En este rango habrá un pH donde la actividad será máxima, y un pH extremo donde la enzima tendrá una actividad mínima.
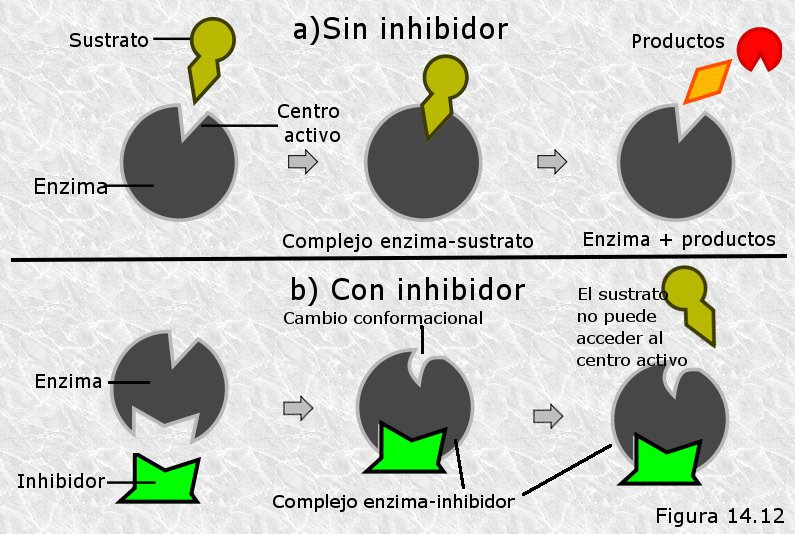
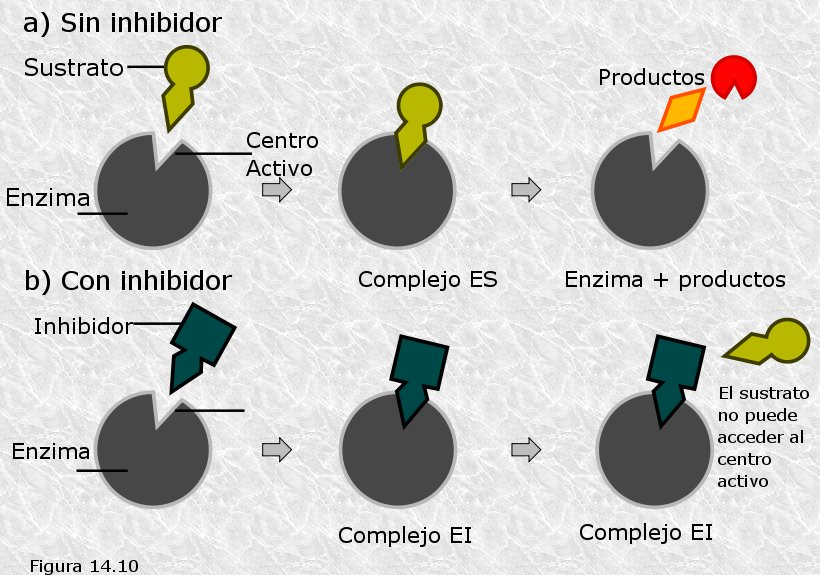
Inhibidores enzimáticos:
Son compuestos que tienen afinidad por el sitio activo (S.A.) de la enzima o alguna otra parte de la proteína, disminuyendo o anulando la actividad enzimática. Pueden ser iones, moléculas inorgánicas, orgánicas e incluso el propio producto de la reacción enzimática.
De acuerdo al tipo de reacción que tienen los inhibidores los podemos clasificar en dos:
- Inhibidores reversibles: inhiben, de forma temporal, la actividad enzimática
- Inhibidores irreversibles: inhiben de forma irreversible la actividad enzimática, ya sea porque se unen de forma permanente al S.A. o porque cambian su estructura.
Además, dependiendo del lugar de unión Inhibidor-Enzima, podemos clasificarlos en:
- Inhibidores competitivos: Cuando el sitio de unión a la enzima es el sitio activo de la misma.
- Inhibidores no competitivos: Cuando el sitio de unión a la enzima es distintos del sitio activo.
Inhibidor competitivo:
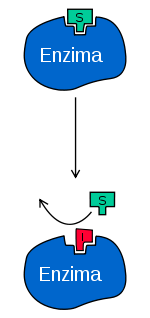
Inhibidor no competitivo: