Fenómenos Químicos Clase 1
Camilo Meza Gaete
12 de Febrero de 2020
Created: 2020-03-05 jue 15:59
¿Qué aprecias en las siguientes imágenes?


El tipo de cambio ocurrido es…
Químico.
Recordando: Los Estados de oxidación
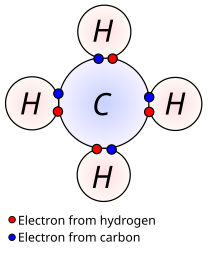
Enlaces químicos
Son las uniones entre dos o más átomos, y pueden ser covalentes o iónicos.
Electrones en los enlaces
Para que estos enlaces se formen, deben interactuar los electrones de la capa más externa del átomo (también llamados electrones de valencia).
Estos electrones pueden compartir una nube electrónica (enlace covalente) o bien intercambiarse entre dos átomos y que éstos queden unidos por electrostática (enlace iónico).
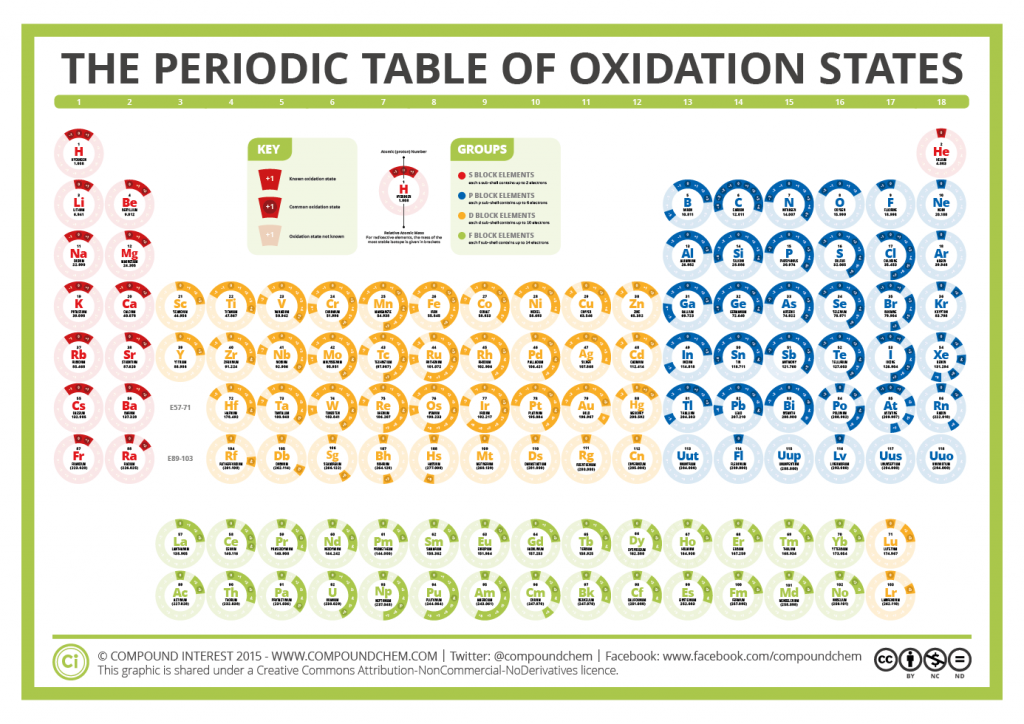
Concepto de Estado de oxidación
A partir de esta reacción:
\begin{equation}
Zn_{(s)} + Cu^{+2}_{(ac.)} \Longrightarrow Zn^{+2}_{(ac.)} + Cu_{(s)}
\end{equation}
- ¿Cuál es la diferencia entre Zn(s) y Zn+2(ac.)?
- ¿Qué dirías que le ocurre?
Cálculo de Estado de oxidación
Existen 7 reglas básicas para determinar el E.O. de un átomo:
- Todo átomo en estado libre, o en una molécula homoatómica se le asigna el E.O = 0.
- El E.O. del Hidrógeno es +1 en la mayoría de compuestos, excepto los hidruros en los que es -1.
- El E.O. del Oxígeno es -2 en la mayoría de compuestos, excepto en los peróxidos (-1), y en el ión superóxido (-1/2).
- El E.O. de un ión monoatómico es igual a su carga.
- La suma algebráica de los E.O. de los átomos en una molécula o compuesto neutro es = 0.
- La suma algebráica de los E.O. de los átomos que componen un ión es siempre igual a su carga.
- Si en la fórmula del compuesto no hay Hidrógeno ni Oxígeno, se le asigna el número de oxidación negativo al átomo más electronegativo.
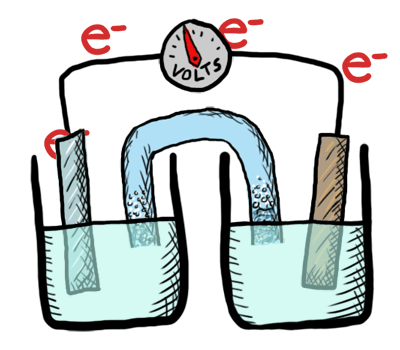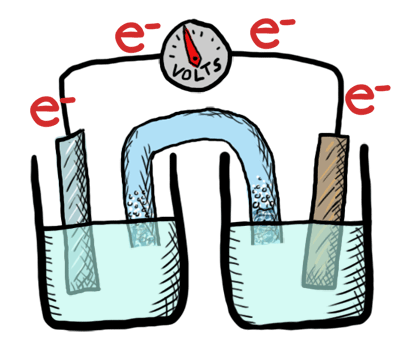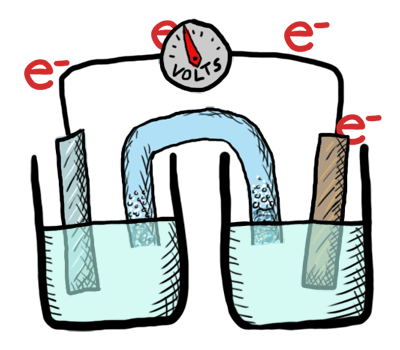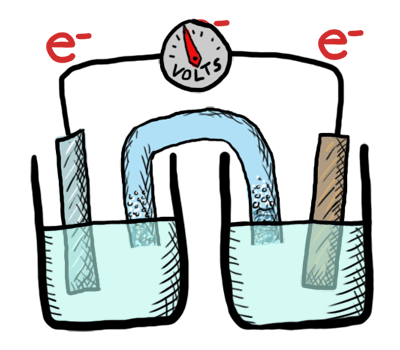
¿Cómo puede una batería almacenar cargas eléctricas?
Intercambiando electrones