Fenómenos Químicos Clase 2
Camilo Meza Gaete
12 de Febrero de 2020
Created: 2020-02-28 vie 15:21
Reacciones de óxidación-reducción
También conocidas como redox son todas las reacciones químicas en las que hay un intercambio de electrones entre dos especies.
Este intercambio permite también pasar de un E.O. a otro, en el ejemplo de la clase anterior.
Se puede notar que el cambio de cargas en las especies sólo puede ser provocado por un intercambio de las partículas subatómicas conocidas como electrones.
Concepto de oxidación
En el caso del Zn,
Pasa de E.O.= 0 a un E.O.= +2.
Llamaremos semirreacción de oxidación a aquella especie que aumenta su E.O. luego de ocurrida la reaccion.
Concepto de reducción
En el caso del Cu,
Pasa de E.O.= +2 a un E.O.= 0.
Llamaremos semirreacción de reducción a aquella especie que disminuye su E.O. luego de ocurrida la reacción.
¿Cuál es el intercambio de electrones?
- El Cu+2 cede 2 electrones y por eso queda neutro.
- El Zn cede 2 electrones y por eso queda con carga positiva.
Recordatorio
Las reacciones de oxidación siempre ocurren junto a una reacción de reducción.
Balance de reacciones redox
Método del ión electrón
Este método permite atender todas las necesidades y especies que presenta la ecuación química, caracterizándose porque los reactivos presentan la forma que tienen en agua.
Las reglas para balancear reacciones por este método son:
Se divide la ecuación en dos semirreacciones (incompletas): una de oxidación y una de reducción.
Se balancea independientemente cada semirreacción:
- Primero, se balancean los elementos distintos de Hidrógeno y Oxígeno.
- Cuando es en medio ácido, se balancea los átomos de Oxígeno añadiendo moléculas de agua (H2O) en la misma cantidad y al lado que falten oxígenos. En medio básico es al revés.
- Si el medio es ácido, se balancean los átomos de Hidrógeno añadiendo iones hidrógeno (H+); y si el medio es básico, se añaden iones hidroxilo (OH-).
- Finalmente se balancea la carga de la ecuación, agregando electrones (e-) donde exista más carga positiva global.
Si existe diferencia entre el número de electrones que se ceden y se captan entre las semirreacciones, multiplicando cada una por números enteros de modo que el número de electrones que se pierden en una semirreacción sea igual al número de electrones que se ganan en la otra.
Finalmente se suma las dos semirreacciones y se simplifica todo aquello que sea posible, cancelando las especies que aparecen en ambos lados de la ecuación, para obtener la reacción global.
Ejercicio resuelto
Balancear la siguiente reacción
Celda galvánica
Durante la primera clase nos preguntábamos cómo podía una batería almacenar algo como cargas, ya que los electrones se están moviendo siempre.
Combinación de dos metales
Luigi Galvani estaba experimentando con músculos de rana y metales; cuando logra encontrar que al presionar dos metales distintos producían la contracción del músculo. Le comentaría el hallazgo a su amigo Alessandro Volta, quien estaba convencido de que el músculo no era necesario para la producción de esa corriente eléctrica.
Volta formaría un modelo bastante simple: placas de Zinc y de Cobre alternadas y separadas por unos paños humedecidos en un electrolito (agua con sal, ácido acético, jugo de limón).
Pila voltaica
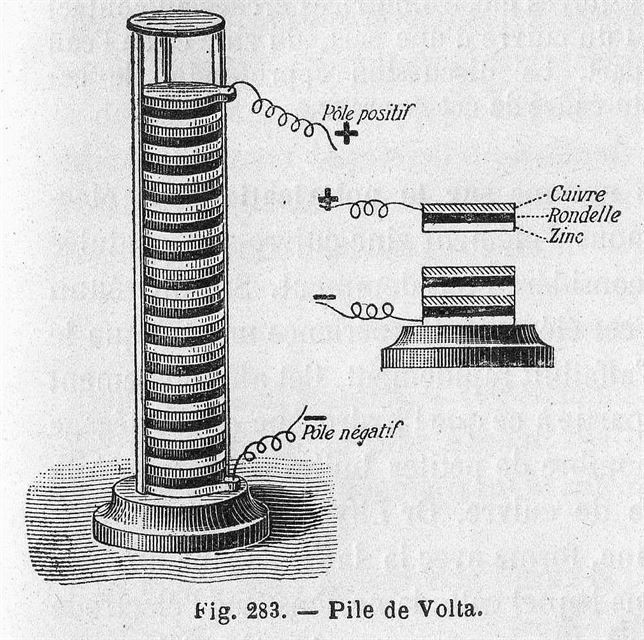
La generación de diferencia de potencial eléctrico entre los dos puntos de la pila estaría dada por la transmisión de electrones entre Zn y Cu, e íntimamente relacionado con la constante de la Keq. propia de la reacción.