Fenómenos Químicos Clase 3
Camilo Meza Gaete
12 de Febrero de 2020
Created: 2020-03-05 jue 10:58
Concepto de ácido y de base
Tanto en alguimia como en química el concepto de ácido se popularizó mucho respecto de los experimentos en fase acuosa; por su parte el concepto de alkali también quedó en la memoria de los experimentadores hasta que durante el inicio del siglo XX se les daría una definición formal basada en la experiencia.
Exploraremos las bases físicoquímicas de las reacciones acuosas de ácido-base para posteriormente aplicarlas en contexto cotidiano.
Modelo electrolítico
Svante Arrhenius estudiaba la conducción de electricidad a través del agua, proceso que se conoce como electrólisis pues es capaz de formar compuestos en el Cátodo y en el Ánodo del circuito eléctrico.
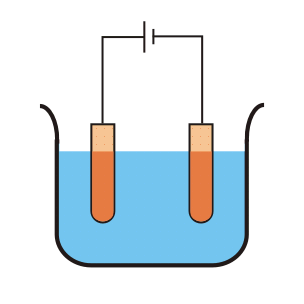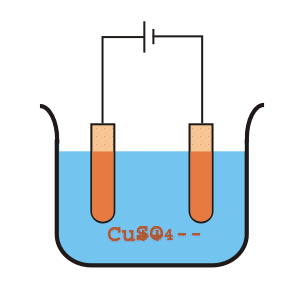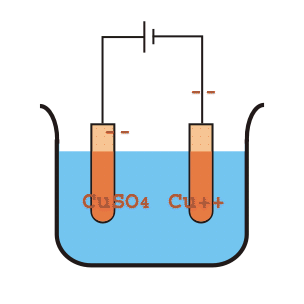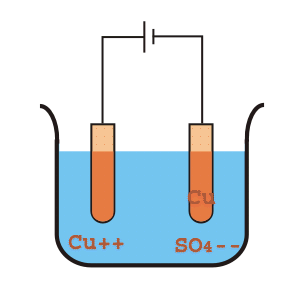
Esta capacidad de transmitir cargas eléctricas entre ambos extremos permitía sospechar de la existencia de especies disueltas en el agua, que Arrhenius llamó electrolitos.
Cuando se utiliza agua pura la conducción es muy leve, por lo que Arrhenius se preguntó qué podría hacer que una molécula neutra transmita la electricidad. Formula así el modelo electrolítico de ácido-base.
En este modelo, un Ácido será aquella especie que entregue iones Hidrógeno (H+) en disolución acuosa, de la siguiente manera:
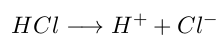
Mientras que una base será aquella que aumente la concentración de iones Hidroxilo (OH-) en disolución acuosa, por ejemplo:
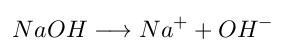
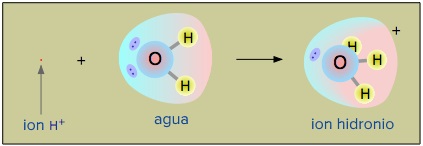
Cabe destacar que la especie ión Hidrógeno no existe de manera química, en realidad lo que pasa es que una molécula de agua capta un ión Hidrógeno del medio, formando ión Hidronio (H3O+):
Finalmente, como el agua pura es capaz de conducir un poco de corriente eléctrica, Arrhenius postula que ocurre una reacción ácido-base en el agua llamada autoionización.
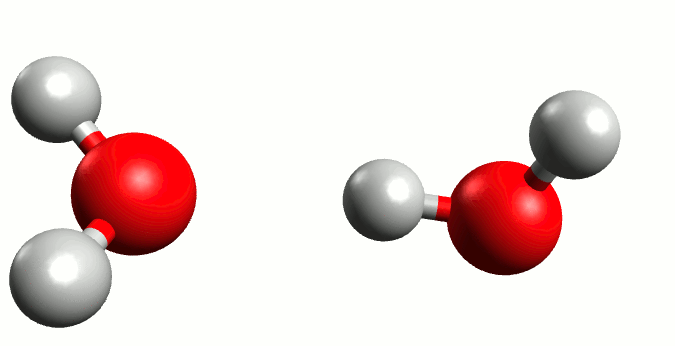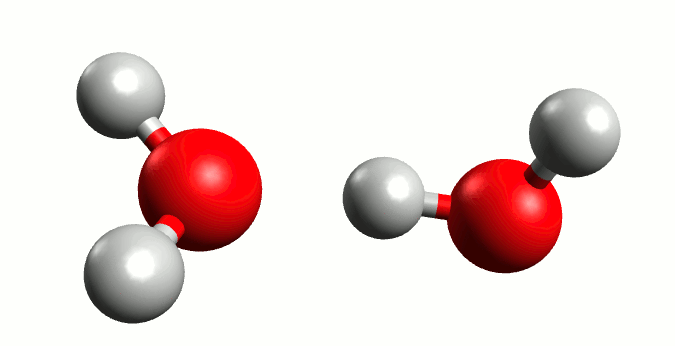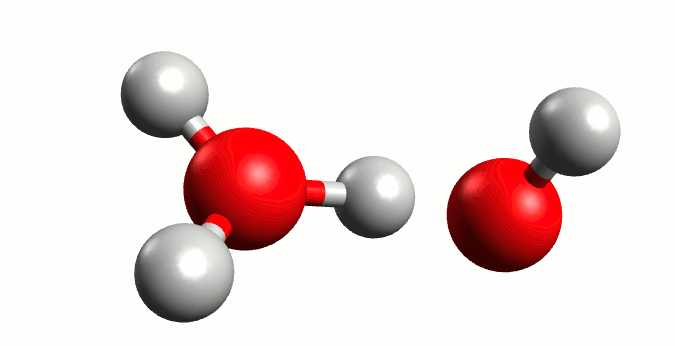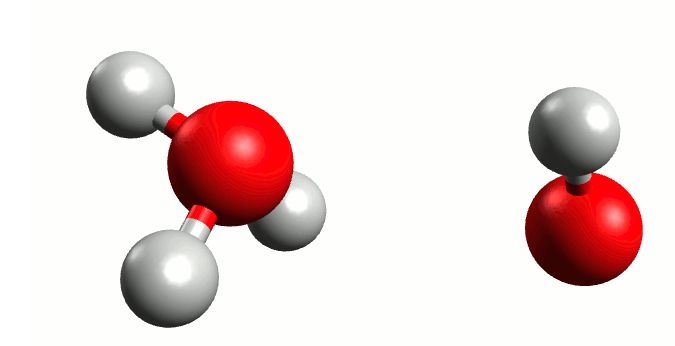
Este proceso tiene como consecuencia el establecer un equilibrio; Arrhenius definiría los electrolitos fuertes como aquellos que se disocian completamente en medio acuoso, aplicando a ácidos y bases sería que al equilibrio no esté presente la molécula original de ácido o base.
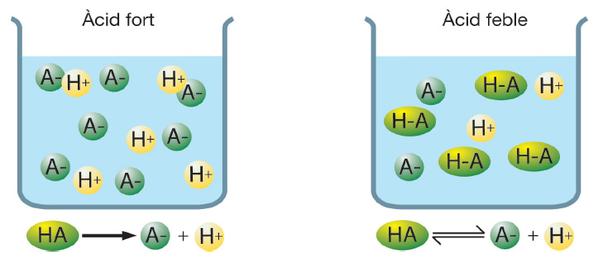
Teoría ácido-base de Lowry-Brönsted
En este caso, en vez de formar electrolitos, se propone la transferencia de un ión Hidrógeno (H+) entre dos especies. La que dona el ión se le denomina ácido mientras que la que recibe el ión se le denomina base.
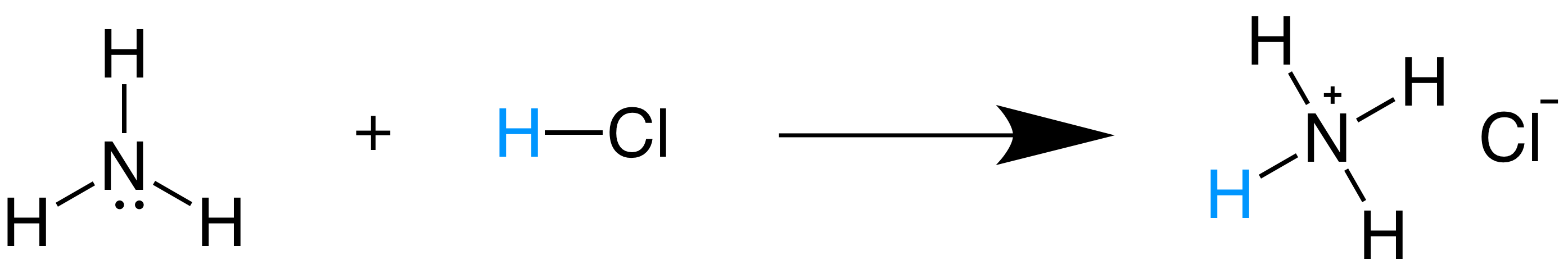
Como podrán darse cuenta, en la reacción anterior no se producen iones Hidrógeno (H+) sino que esta especie es transferida, además que la base en ese caso no produce iones Hidroxilo (OH-). Para profundizar en eso, podemos estudiar el siguiente ejemplo:
O este ejemplo en que se establece un equilibrio entre las especies:
pH, pOH y la escala de pH
¿Dónde han visto o escuchado el concepto de pH?

Si nos enfocamos en medir la concentración de iones H+ y OH- en agua pura a 25 °C es de 10-7 [M]. Mientras que en el líquido estomacal, la concentración de iones H+ es de hasta 10-1; y la de OH- es de 10-13.
Podemos notar que el líquido estomacal es hasta 1 millón de veces más ácido que el agua pura.
Esta diferencia nos da nociones del principio químico conocido como equilibrio.
Definiciones de pH y pOH
Sin embargo, resulta incómodo trabajar con esas magnitudes porque la notación científica es contraintuitiva; utilizaremos el mismo método que un trabajador usó para medir la acidez de bebidas gaseosas: Aplicar función logaritmo.
Concentración de H+ y pH
La expresión del inverso aditivo del logaritmo se denomina p, por lo que tendremos:
Por ejemplo, si tenemos una concentración de H+ de 10-5 [M]:
Concentración de OH- y pOH
Así mismo, podemos definir el pOH en función de la concentración de OH- en disolución.
Por ejemplo, si tenemos una concentración de OH- de 10-9 [M]:
Relación entre pH y pOH
Según lo ya visto por autoionización del agua, en esta sustancia pura las dos especies de electrolitos se encuentran en igual concentración (10-7), si aplicamos las definiciones anteriores:
Estableciendo el siguiente equilibrio:
Aplicando la función -log a ambos lados de la ecuación tendremos:
Según la propiedad de logaritmos multiplicación de argumentos:
Kw se conoce en CNTP, y es igual a 10-14, por lo que resulta:
Si calculamos eso, y reconocemos que por definición -log es la función p, la ecuación quedará así: