Unidad 1, Clase 1: Teorías Ácido-Base
Autor: Camilo Meza Gaete
Contacto: [email protected]
Modelo de Svante Arrhenius
Durante 1833, el químico sueco Svante Arrhenius experimentaba con los electrolitos en las disoluciones acuosas.
Sabemos que el agua requiere de electrolitos disueltos para conducir electricidad, pero además tenemos otras especies que pueden cambiar este comportamiento; según la teoría de Arrhenius son:
- Un ácido será una sustancia que contiene hidrógeno y se ioniza, produciendo protones (H⁺) en solución acuosa.
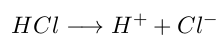
- Una base será una sustancia que contiene hidroxilo (OH⁻) y lo libera al disociarse en solución acuosa.
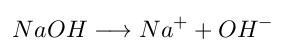
Modelo de Lowry & Brönsted
El químico danés, Johannes Brönsted y el químico inglés Thomas Lowry propusieron (de manera independiente) un modelo más amplio de ácidos y bases que se enfoca en el intercambio del ión hidrógeno (H⁺).
- Un ácido será toda especie que done hidrógeno (H⁺) en disolución acuosa.
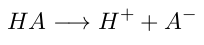
- Una base será toda especie que reciba hidrógeno (H⁺) desde la disolución acuosa.
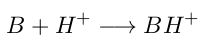
Modelo de Lewis
También conocido como el modelo electrónico, utiliza las estructuras de octetos de Lewis para definir ácidos y base; este modelo abarca aún más reacciones que los anteriores.
- Un ácido será aquella especie que, en disolución acuosa, acepte pares electrónicos no-enlazantes.
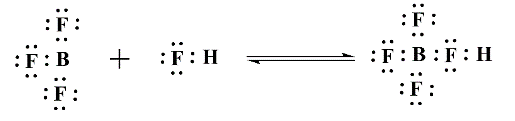
- Una base será aquella que, en disolución acuosa, done pares electrónicos no-enlazantes.
