Unidad 1, Clase 2: Producto iónico del Agua
Autor: Camilo Meza Gaete
Contacto: [email protected]
Recordando el equilibrio
Las pruebas de Arrhenius nos presentaron un escenario nuevo en las investigaciones del comportamiento del agua.
La conducción del agua pura, medida a 25 [°C], nos insta a pensar que esta molécula contiene lo que Arrhenius denomina "electrolitos". Pero ¿Cómo puede ser esto, si el agua es una molécula eléctricamente neutra?
Propuesta: una molécula de agua reacciona con otra, recibiendo un protón (H⁺) y generando dos especies cargadas:
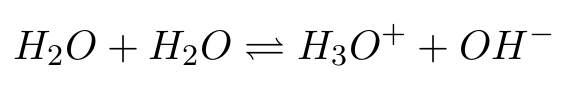
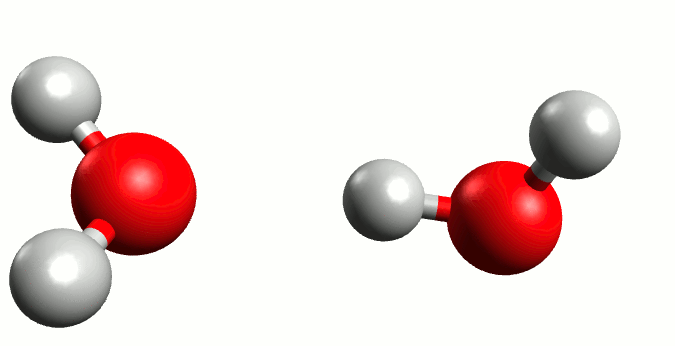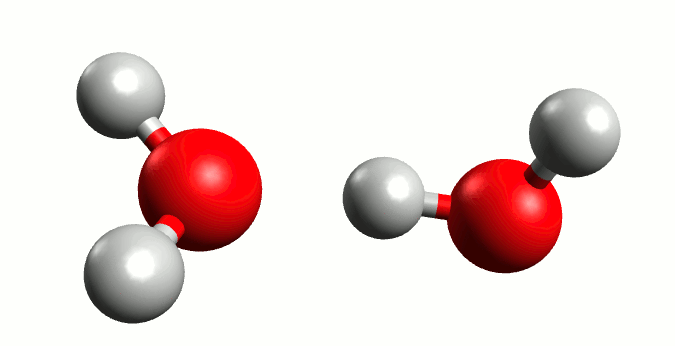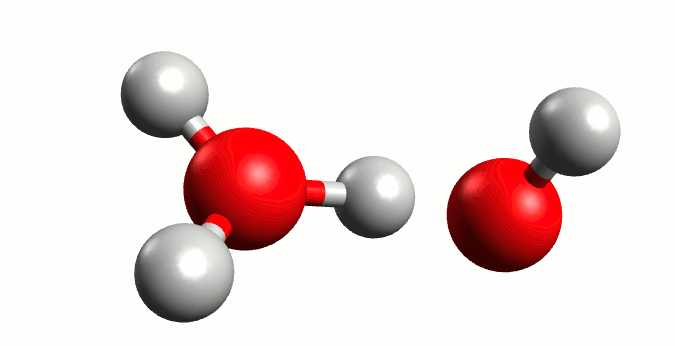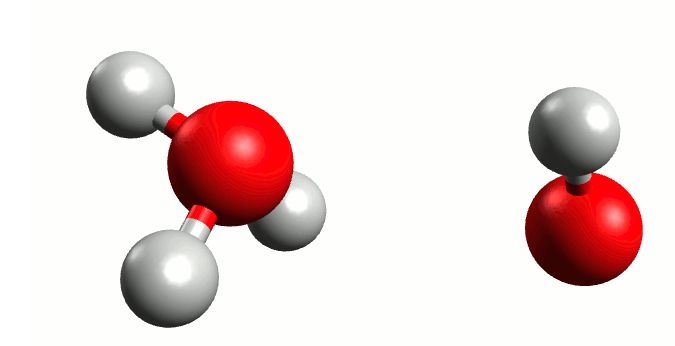
De esta manera, si recordamos las bases del equilibrio químico, podríamos formular lo siguiente:
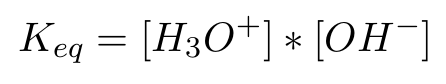
Esta constante, medida experimentalmente a 25 [°C], Es igual a 10⁻¹⁴.
Implicancias de la constante de equilibrio del agua
El echo de que podamos expresar este proceso de autoionización en términos de una constante nos ayuda a predecir lo siguiente:
La disolución de ácidos o bases en el agua genera un cambio en esta constante de equilibrio (principio de Le Chatelier), este cambio es cuantificable y le confiere a la disolución su propiedad ácida o básica.
Estos cambios cuantificables son la relación entre las concentraciones de Hidronio e Hidroxilo.
Como estos cambios de concentración son en escalas muy pequeñas (entre 0 y 1 [M]), podemos entonces utilizar la herramienta matemática del - logaritmo (también conocido como p), expresando nuestra escala de concentración entre 0 y 14, siendo el punto medio (7) el neutro del agua pura.
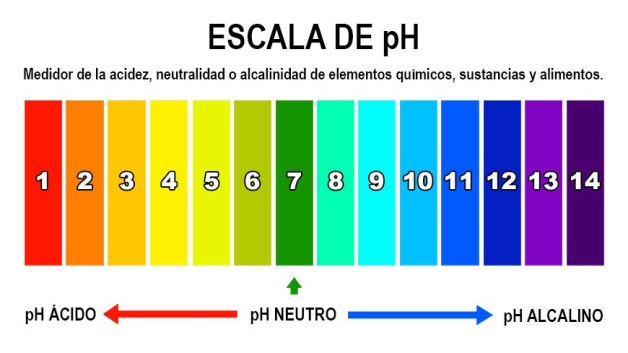
Recordemos que este punto neutro es porque en el agua pura, l a concentración de Hidronio e Hidroxilo son iguales (10⁻⁷).