Unidad 1, Clase 3: Fortaleza de ácidos y bases
Autor: Camilo Meza Gaete
Contacto: [email protected]
¿Qué significa fuerte o débil referido a un ácido y una base?
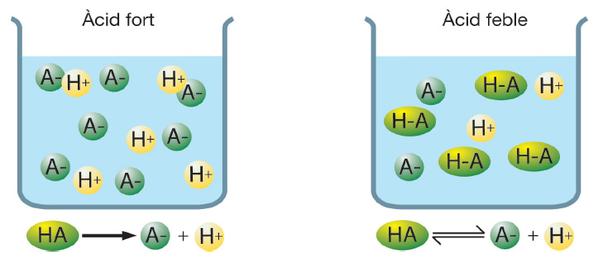
De forma cualitativa y según la teoría de Arrhenius, un ácido o una base es fuerte cuando en disolución acuosa se encuentra totalmente disociado, mientras que es débil si el grado de disociación es bajo.
El caso de los ácidos
- Ácidos fuertes: Se ionizan completamente en agua, liberando sus H⁺.
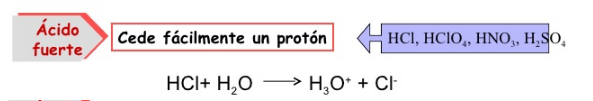
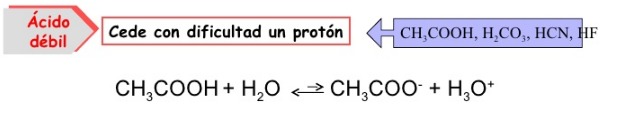
- Ácidos débiles: En disolución acuosa, se ionizan parcialmente; lo que genera un equilibrio entre reactantes y productos.
Ejemplos de ácidos comunes:

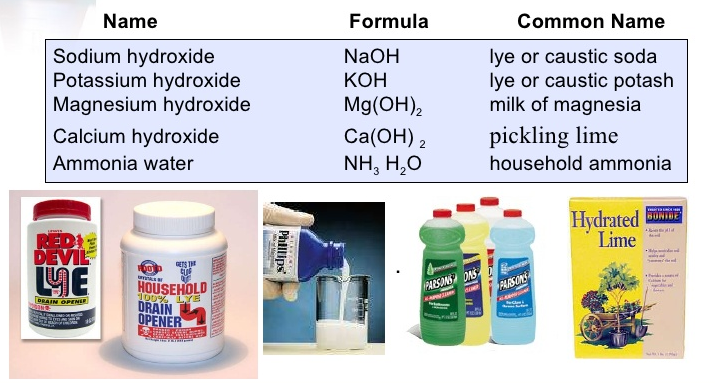
El caso de las bases
- Bases fuertes: Se ionizan completamente en agua, liberando sus OH⁻.

- Bases débiles: En disolución acuosa, se ionizan parcialmente; lo que genera un equilibrio entre reactantes y productos.

Ejemplos de bases comunes:
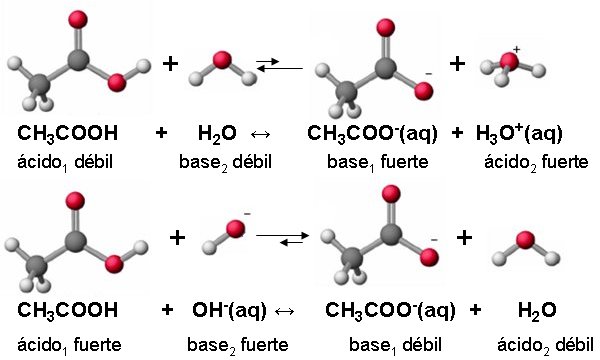
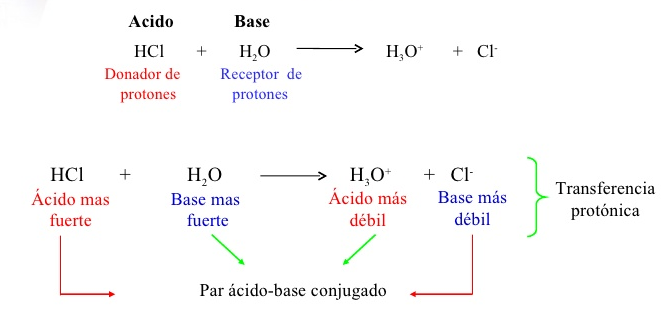
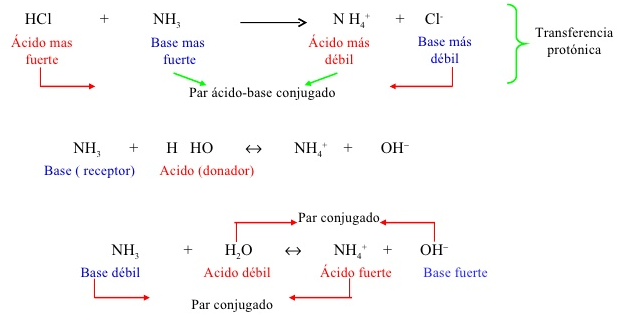
Pares ácido-base conjugados
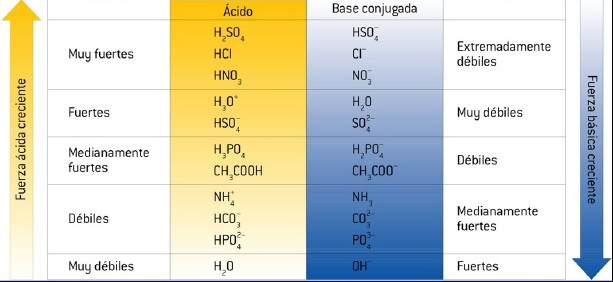
Constante de equilibrio
Las concentraciones en equilibrio de reactivos y productos se relacionan mediante la constante de acidez (Ka), cuya expresión es:
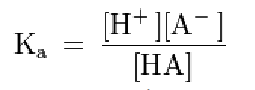
Cuanto mayor es el valor de Ka, más se favorece la formación de iones H⁺, y más bajo es el pH de la disolución. La Ka de los ácidos débiles varía entre 1,80×10⁻¹⁶ y 55,50.
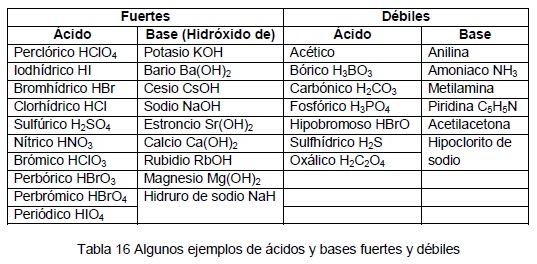
Los ácidos con una constante Ka < 1,80×10⁻¹⁶ son ácidos más débiles que el agua.
Los ácidos con una constante Ka > 55,50 se consideran ácidos fuertes y se disocian casi en su totalidad cuando son disueltos en agua.