Reacciones Químicas Cotidianas Clase 3
Camilo Meza Gaete
12 de Febrero de 2020
Created: 2020-05-19 Tue 13:47
Teoría atómica de Dalton
John Dalton realiza grandes aportes a la ciencia de la química (desde su postulado de la ley de proporciones múltiples, hasta la donación de sus ojos para avanzar la investigación de la condición actualmente conocida como daltonismo).

Pero también aportó con las siguientes ideas a la formación de la actual teoría atómica:
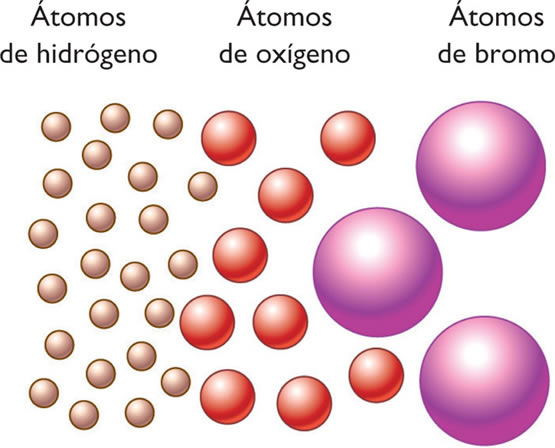
- Los elementos químicos están formados por partículas muy pequeñas e indivisibles llamadas átomos.
- Los átomos de un mismo elemento son siempre idénticos.
¿Cómo se forman los compuestos?
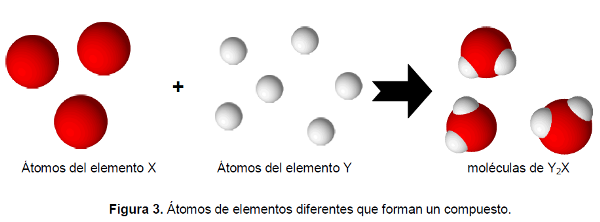
La teoría de Dalton permitía pensar los compuestos como un conjunto de átomos a través de estos dos postulados:
- Los compuestos están formados por más un elemento en relación de números enteros.
- Una reacción química es el proceso de separación, combinación, o reordenamiento de los elementos en un compuesto.
Modelo atómico de Thomson
El modelo de Dalton sirve parasentar las bases de la actual teoría atómica; pero no nos explica la naturaleza de la electricidad.
Durante finales del siglo XIX, el descubrimiento del electrón, y por lo tanto de la naturaleza eléctrica de la materia nos entregó un nuevo modelo atómico.
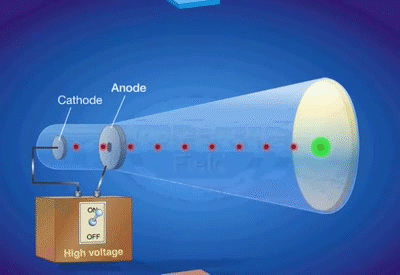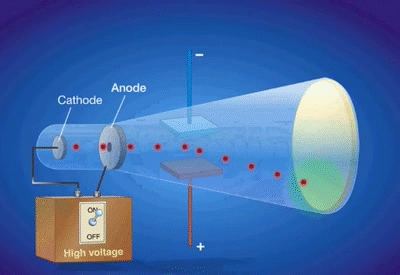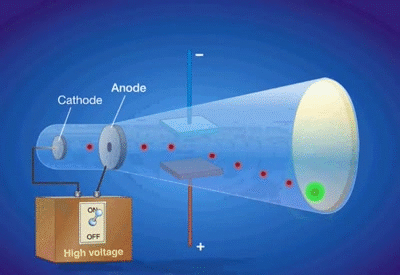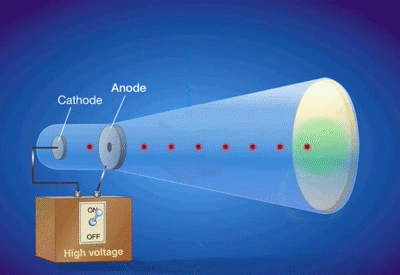
El experimento de los rayos catódicos de J. J. Thomson nos permite estudiar la materia de una nueva forma: La materia compuesta por partículas con carga eléctrica.

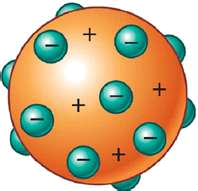
Bautiza a su modelo como “budín de pasas”, debido a la similitud que en su imaginación tenían estas dos especies.

Modelo atómico de Rutherford
Unos años más tarde, otro físico haciendo experimentos con partículas alfa idearía otro modelo para el átomo.
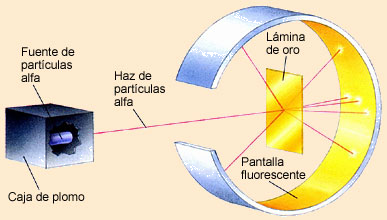
En el laboratorio de Ernest Rutherford, los datos encontrados con este experimento hacían menos probable el modelo de Thomson, y se ideó el concepto de núcleo en el átomo:

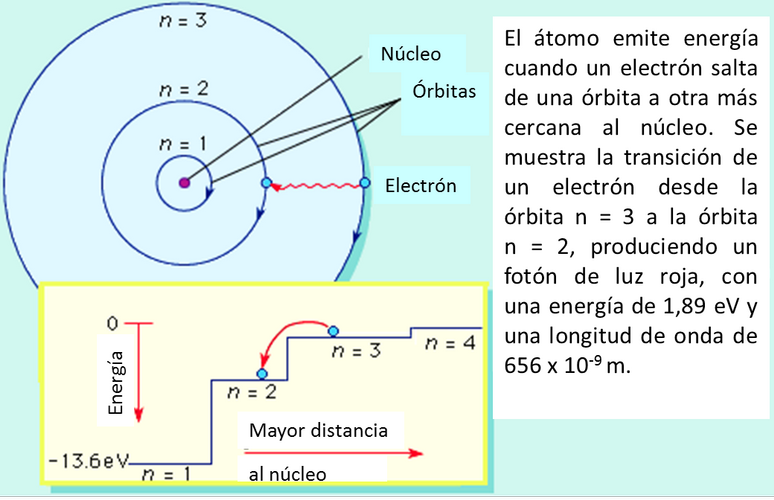
Modelo atómico de Bohr
Sin embargo, el modelo atómico de Rutheford no podía explicar cómo era posible que los electrones no colapsaran sobre el núcleo.
No sería sino hasta 1922 que el físico danés Niels Bohr junto a las conjeturas de Plank modelaría matemáticamente el átomo de hidrógeno.
Además, a principios del siglo XX había un misterio que tenía pasmada a la comunidad científica: Los espectros de absorción y emisión de los elementos químicos.

Este espectro de absorción, sería explicado completamente por las ecuaciones que Niels Bohr plantearía.
Modelo atómico contemporáneo
A pesar de que el modelo atómico de Bohr es capaz de explicar bastante bien lo que ocurre a nivel sub-atómico con un solo electrón.
Al aumentar el número de electrones pierde su poder explicativo y necesitamos de otro modelo: el modelo mecano-cuántico que revisaremos en la próxima clase.