Química Cotidiana Clase 4
Camilo Meza Gaete
Created: 2023-03-22 Wed 12:20
Experimento de la doble rendija
Pero el modelo de Bohr tenía sus límites, uno de los cuales es el experimento de la doble rendija.
Ecuación de función de onda
Erwin Schrödinger propone una ecuación para complementar el comportamiento dual que tienen los electrones frente a este experimento (partiendo de una crítica).
Esta ecuación se representa así:
\[i \hbar \frac{\partial}{\partial t} \Psi(\mathbf{r},t) = \hat H \Psi(\mathbf{r},t) \]
Si se resuelve dicha ecuación obtenemos funciones de onda que indican la probabilidad de hallar un electrón.
Números cuánticos
De la ecuación antes mencionada, emergen cuatro números cuánticos:
- Número principal o energético (n)
- Indica la energía del espacio orbital, mientras mayor el número más alejado del núcleo.
- Número secundario o azimutal (l)
- Indica la forma que tiene el espacio orbital, depende del valor de n y parte desde 0 hasta (n-1).
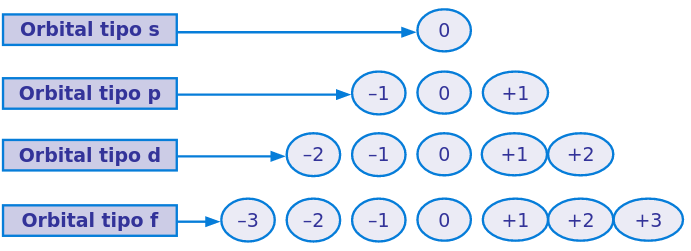
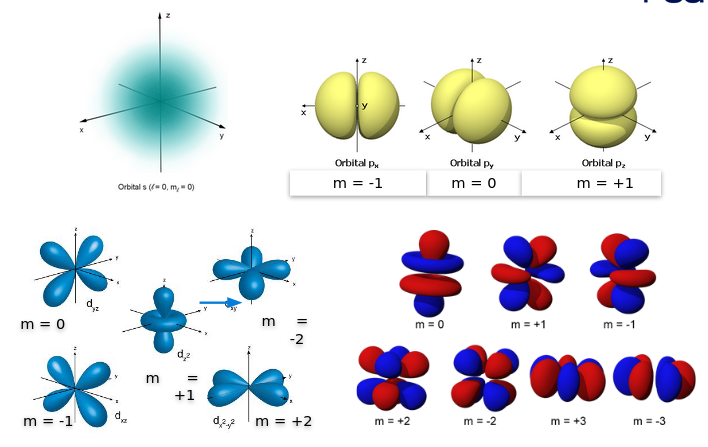
- Número magnético (m o \(m_{l}\))
- Indica la orientación espacial de los orbitales, considera los valores enteros desde -l hasta +l.
- Número de espín (s o \(m_{s}\))
- Indica el sentido de rotación que tiene el electrón respecto de su propio eje, puede tomar el valor \(-1/2\) o \(+1/2\).
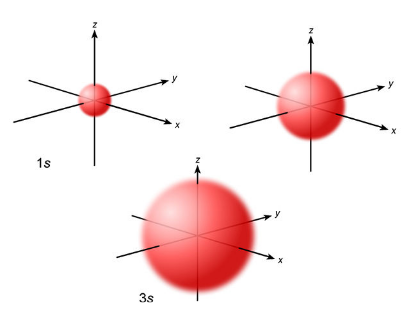
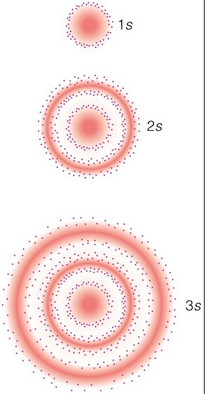
Número cuántico principal
Indica la distancia entre el electrón analizado y el núcleo, se representa como capas.
Número cuántico secundario
Corresponde a la forma que tendrá el orbital del electrón analizado.

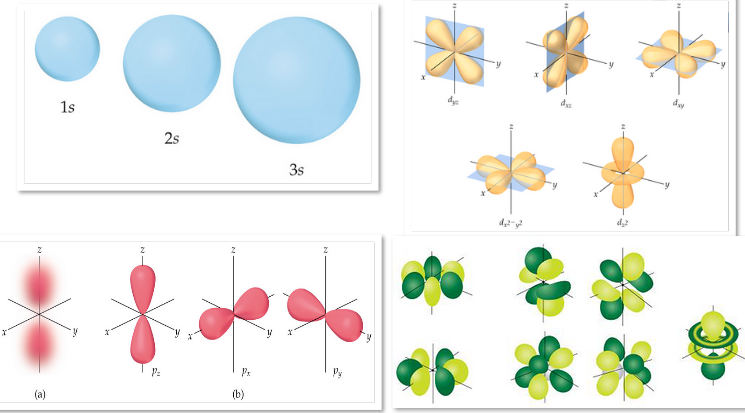
El número cuántico secundario, tiene un límite de electrones particular según el tipo de orbital que corresponde:
| Tipo de orbital | Valor | Número de orbitales | Número de electrones |
|---|---|---|---|
| s | 0 | 1 | 2 |
| p | 1 | 3 | 6 |
| d | 2 | 5 | 10 |
| f | 3 | 7 | 14 |
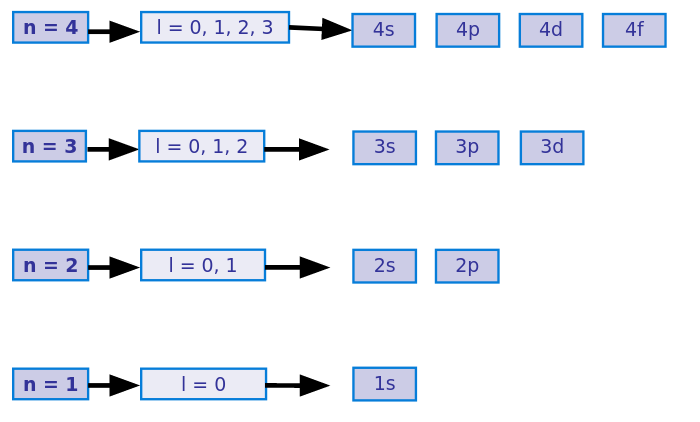
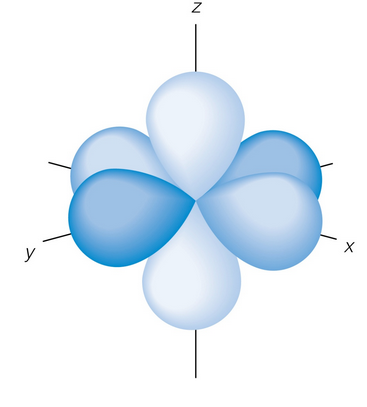
Número cuántico magnético
Como indica la orientación, depende del número cuántico azimutal: