Reacciones químicas cotidianas Clase 5
Camilo Meza Gaete
Created: 2023-03-15 Wed 17:53
Núcleo atómico
Clasificaciones
De la clase anterior logramos comprender la estructura interna de un átomo, ahora los clasificaremos de acuerdo a distintos criterios.
Números A y Z
Cuando se estudia un símbolo atómico, viene acompañado de dos números que nos permiten conocer su estructura nuclear:
- Número atómico (Z)
- Número de protones presentes en el núcleo, le confiere el símbolo al átomo (todos los átomos de Hidrógeno, por ejemplo, tienen sólo 1 protón).
- Número másico (A)
- Número de partículas subatómicas presentes en el núcleo (tanto protones como neutrones).
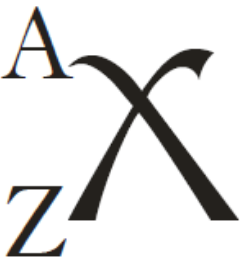
Nube electrónica
Iones
Un átomo se encuentra eléctricamente neutro cuando la cantidad de electrones es igual a la cantidad de protones correspondientes a dicho átomo.
Pero los electrones se pueden mover de un átomo a otro, formando lo que conocemos como iones.
- Catión
- Ión positivo, se forma por la pérdida de electrones respecto del átomo basal.
- Anión
- Ión negativo, se forma por la ganancia de electrones respecto del átomo basal.
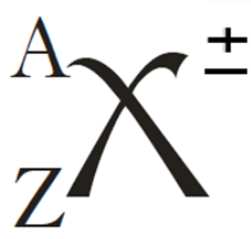
Clasificaciones de átomos
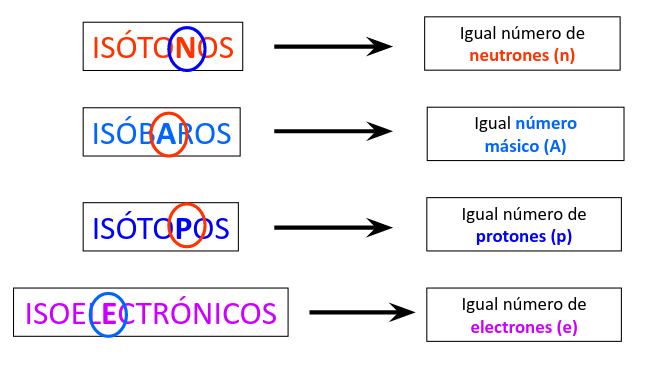
Isótopos
No todos los átomos de un mismo elemento poseen la misma masa atómica, cuando esto ocurre nos encontramos con los llamados isótopos.
Los isótopos de un elemento son todos aquellos que tienen el mismo número atómico pero tienen un número másico diferente.
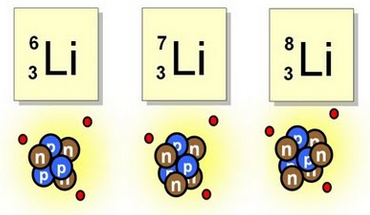
El Hidrógeno por ejemplo tiene 3 isótopos naturales:
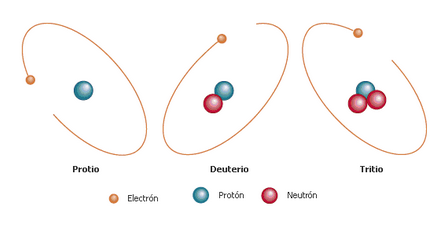
Isóbaros
Cuando dos átomos de distintos elementos comparten un mismo número másico, se denominan isóbaros.
Esto también se puede reducir a que tienen el mizmo A, pero distinto Z como los ejemplos a continuación:


Isótonos
En un tercer caso, dos átomos pueden no coincidir ni en su número atómico ni en su número másico. Pero pueden llegar a tener el mismo número de neutrones por lo que se denominan isótonos.
Para determinar si dos átomo son isótonos entre sí, debemos restar el número atómico al número másico correspondiente (A - Z), como se muestra en el siguiente ejemplo:
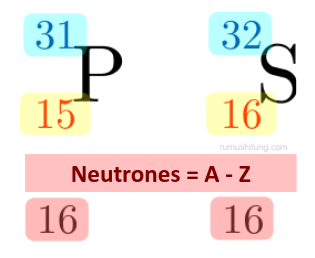
Isoelectrónicos
Además de las clasificaciones nucleares, existe la clasificación respecto del número de electrones.
Dos átomos son isoelectrónicos cuando la cantidad de electrones es igual en ambos átomos comparados.
Por ejemplo el catión magnesio y el anión oxígeno:
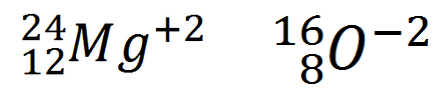

Resumen