Reacciones químicas Clase 1
Camilo Meza Gaete
Created: 2023-06-15 Thu 13:21
Tabla periódica
Fue propuesta de manera separada pero en tiempos aproximados tanto por Dimitri Mendeleiev como por Lothar Meyer, durante mediados del siglo XIX.
Su enorme poder explicativo es lo que nos permite actualmente seguir utilizando este método de ordenamiento basado en el número atómico de los elementos.

Grupos y períodos
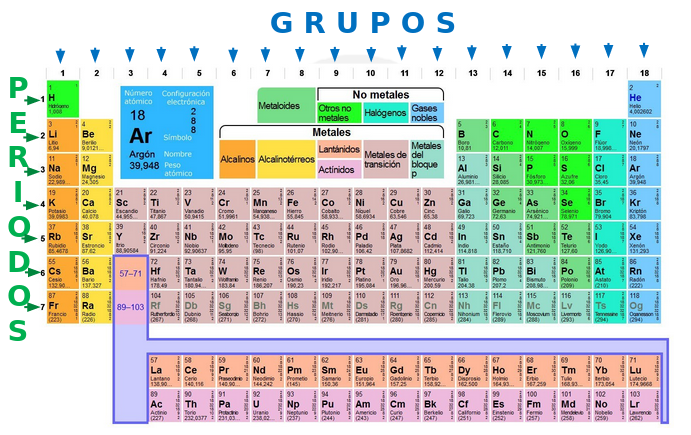
- Grupo
- En la tabla periódica son los elementos que presentan propiedades físicas y químicas similares. Tienen siempre la misma cantidad de electrones de valencia en su último nivel energético.
- Período
- Son todos los elementos que tienen propiedades físico-químicas distintas pero que tienen sus electrones de valencia en el mismo nivel de energía.
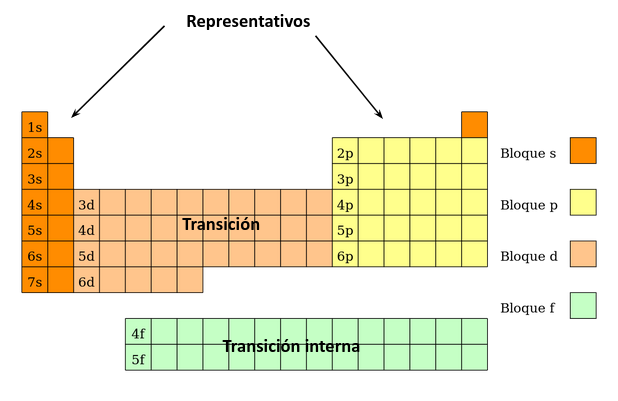
Propiedades periódicas
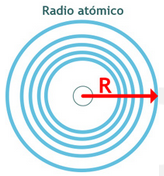
Radio atómico
Corresponde a la distancia que se encuentra entre el núcleo y el electrón más externo del átomo.
Volumen atómico
Es el espacio que ocupa el átomo, depende del radio atómico del mismo.
Estas dos propiedades aumentan en la tabla periódica de la siguiente manera:
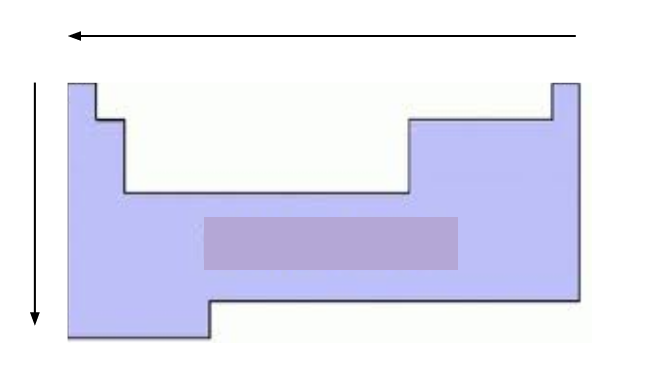
Electronegatividad
Corresponde a la capacidad de un átomo para atraer hacia sí los electrones en un enlace.
El elemento más electronegativo es Flúor (F).
Potencial de ionización
Es la energía necesaria para sacar un electrón desde un átomo en su estado fundamental y gaseoso.
\[A_{g} + \bar{E}_{P.I.} \Rightarrow A_{g}^{+} + e^{-}\]
Electroafinidad
Es la energía liberada cuando se agrega un electrón al átomo en su estado fundamental y gaseoso.
\[X_{g} + e^{-} \Rightarrow X_{g}^{-} + \bar{E}_{E.A.}\]
Las tres propiedades aumentan siguiendo el diagrama a continuación: