Reacciones químicas Clase 2
Camilo Meza Gaete
Created: 2023-06-07 Wed 11:11
Enlace químico
Las moléculas se forman por medio de la unión entre dos o más átomos, pero ¿Cómo se unen los átomos? ¿Qué es un enlace químico? ¿Existe más de un tipo de enlace?.
Enlace químico
Unión entre átomos que ocurre debido a la interacción de sus correspondientes nubes electrónicas.
Los electrones que interactúan entre los átomos son los del nivel más externo, conocidos también como electrones de valencia.
- Esta interacción les permite a los átomos obtener la configuración electrónica de un gas noble, presentando los niveles superiores completos y estables.
- Los electrones se pueden compartir o transferir entre los átomos partícipes del enlace, cumpliendo con la regla del octeto o dueto y se pueden diagramar usando las estructuras de Lewis.
Estructura de Lewis
Ilustra de manera simple, poniendo el símbolo del elemento y rodeándolo por puntos o cruces que corresponde a los electrones de valencia.
Por ejemplo, para el ácido nitroso (\(HNO_{2}\)), tenemos la siguiente estructura:
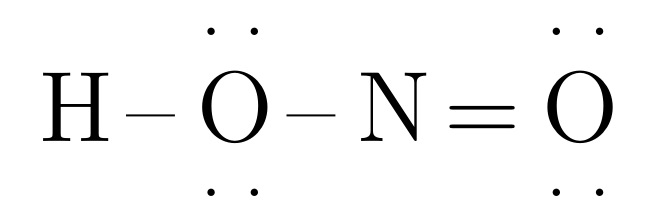
Dibujando la estructura de Lewis
Paso 1: Luego de determinar las configuraciones electrónicas y los electrones de valencia de los átomos participantes, se debe elegir un átomo central (debe ser el menos electronegativo y nunca es hidrógeno).
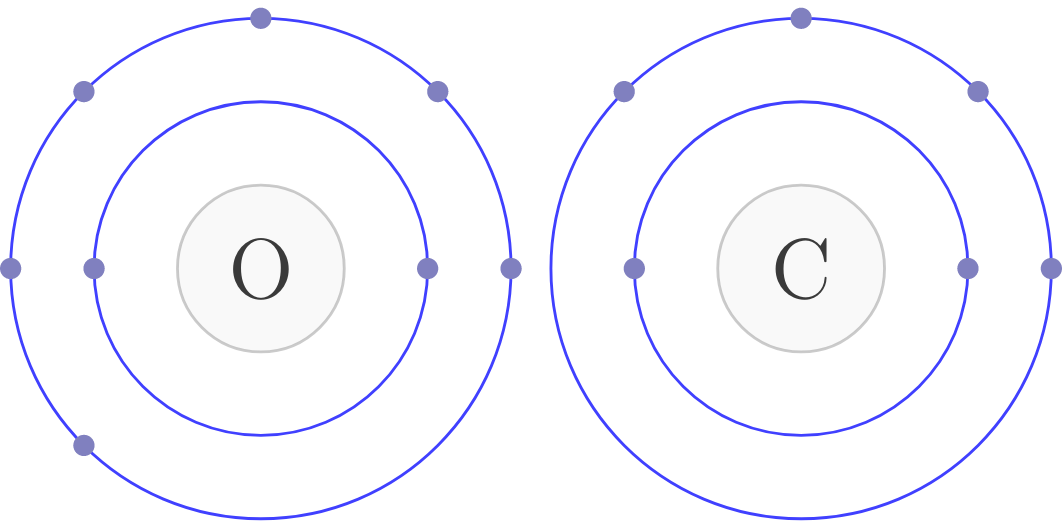
\[_{6}C = 1s^{2}2s^{2}2p^{2}\]
\[_{8}O = 1s^{2}2s^{2}2p^{4}\]
Veamos un ejemplo con la molécula de dióxido de carbono (\(CO_{2}\)), como el Carbono es menos electronegativo que el Oxígeno lo pondremos en el centro:

Paso 2: En nuestro caso, el Carbono tiene 4 electrones y el Oxígeno 6.
Paso 3: Distribuir los electrones de valencia al rededor de cada átomo, en el caso del \(CO_{2}\) se debería ver:

Paso 4: formar un enlace (que toma dos electrones) y establecer un dueto:
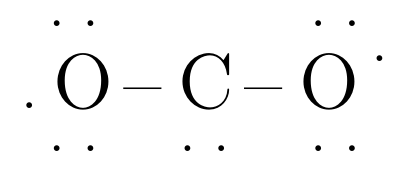
En este caso, no se han formado octetos al rededor de los átomos, por lo que debemos seguir estableciendo enlaces.
Paso 4 bis: Formar enlaces múltiples de ser necesario hasta tener la totalidad de los átomos con un octeto o los duetos que corresponda.
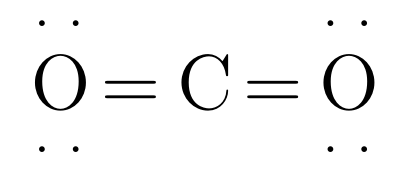
Hibridación de la nube electrónica
Para que un átomo pueda desaparear sus electrones de un determinado orbital, primero debe pasar por un proceso que se denomina hibridación.
Tipos de hibridación
Existen diferentes tipos de hibridación, pero las más relevantes para enseñanza media son la \(sp^{3}\), la \(sp^{2}\), y la \(sp\) que ocurren en átomos similares al Carbono.