Soluciones Químicas Clase 1
Camilo Meza Gaete
Created: 2020-04-01 mié 12:56
¿Qué es una solución química?
Disolver y solvatar
Hay dos conceptos en química cuya apariencia física es similar, pero químicamente son dos procesos distintos:
Por ejemplo, la disolución de sal en agua:

Y como contraparte, la solvatación de azúcar en agua:

¿Qué diferencia a ambos procesos?
Sólo el fenómeno químico que ocurre, y está relacionado con la naturaleza del agua.
Propiedades del agua
El agua tiene la gracia de ser un buen ejemplo tanto en química como en física porque se encuentra en los tres estados de la materia en la naturaleza: Sólido, Líquido y Gaseoso.

Sin embargo, era una extrañeza que el agua (siendo una molécula tan liviana) se encontrara en un estado distinto del gaseoso. Así que comenzaremos por estudiar la naturaleza del agua
Conocemos bien la fórmula molecular del agua: H2O, pero para reconocer sus propiedades, tenemos que saber cómo están ordenados esos átomos en la molécula de agua.
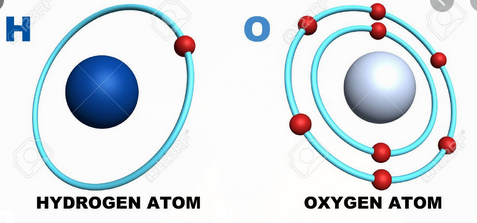
Recordemos que la materia tiene naturaleza eléctrica (porque está compuesta de átomos, los que a su vez tienen las partículas subatómicas con carga conocidas como protones y neutrones.)
Esta diferencia de estructura atómica, es la que permite la forma tridimensional de la molécula de agua:
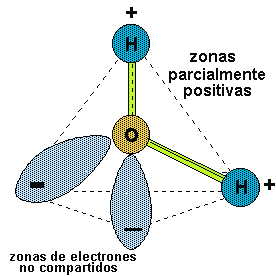
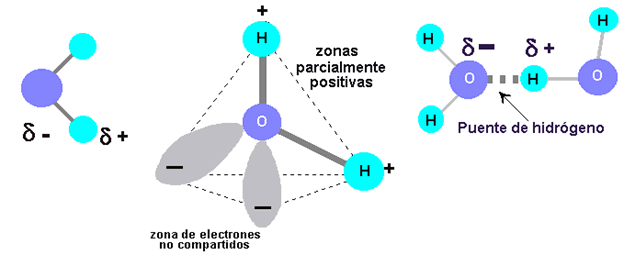
Así, la molécula de agua tiene una diferencia de cantidad de electrones entre un lado y otro de la molécula:
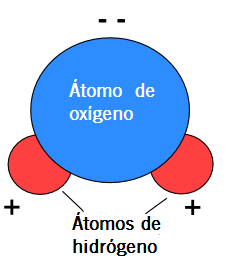
¿Qué ocurre entre dos partículas que tienen cargas opuestas?, como ustedes bien saben: se atraen. Ahora tenemos una molécula que tiene diferencia de carga positiva por un lado, mientras que tiene diferencia de carga negativa por el otro: un dipolo (tal como un imán).
Y, al igual que los imanes, los polos opuestos se atraen.
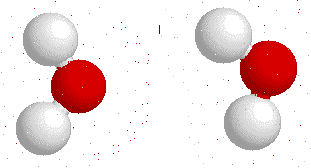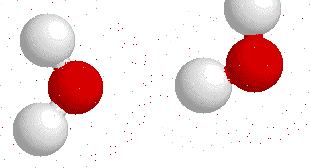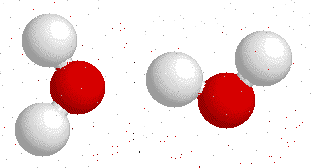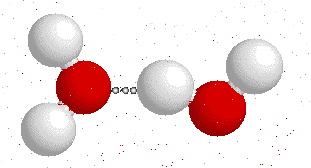
Esta fuerza de atracción intermolecular (entre dos moléculas) se llama puente de Hidrógeno y es la que permite que el agua sea líquida en condiciones normales de presión y temperatura, y además le confiere las propiedades de solvatar o disolver algunas moléculas.