Unidad 1, Clase 4: Primera ley de la Termodinámica
Autor: Camilo Meza Gaete
Contacto: [email protected]
Concepto de Entalpía
Como hemos visto, podemos definir la energía de un sistema como el intercambio de calor o el intercambio de trabajo del mismo
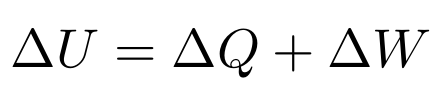
Es evidente que el único trabajo que podemos realizar es el cambio de presión (y por consiguiente un cambio de volumen) en el entorno.
¿Qué ocurre entonces cuando la presión es constante?
Cuando la presión es constante, la única variación del sistema es su calor y su volumen, a este tipo de variación la denominaremos Entalpía , la simbolizamos con la letra H y su unidad de medida son los Joule [J], o Joule/mol [J/mol] en el caso de las reacciones químicas.
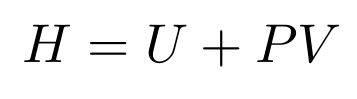
Como es una función de estado, podemos expresarla únicamente como la variación de entalpía entre el inicio y el final de la reacción:

Entalpía de cambio de estado
Puedes notar que la entalpía es equivalente al cambio de calor en un sistema (en condiciones isobáricas). Por lo que podremos definir todos los cambios de estado como un cambio en la entalpía del sistema.
| Reacción | Entalpía [kJ/mol] |
|---|---|
| 2 I(s) -> I2(g) | 7,44 |
| H2 O(s) -> H2 O(l) | 1423 |
| S(rómbico) -> S(monocíclico) | 80 |
Entalpía de formación o de reacción
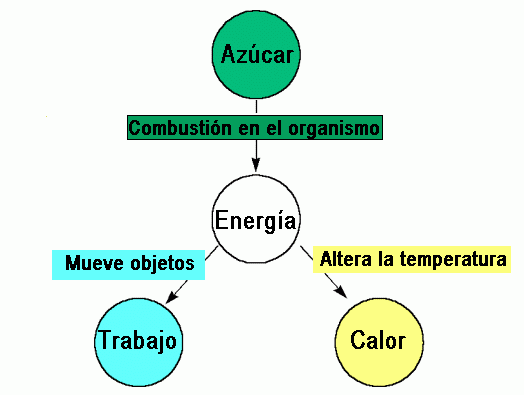
Recordemos lo que implica la energía, por ejemplo, la que obtenemos a partir de uno de nuestros principales nutrientes:
En una reacción química, podremos establecer una diferencia entre la entalpía de reactantes, y de productos. Por ejemplo, la siguiente reacción:
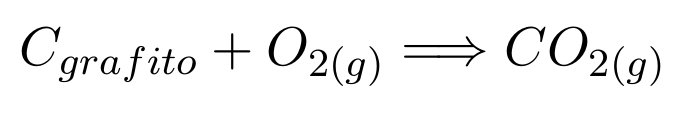
Libera una cantidad de energía igual a 393,5 [kJ/mol]. Podríamos decir entonces que la entalpía de formación del CO2 es 393,5 [kJ/mol]
Si recordamos la ley fundamental de la química, tendremos que pensar lo siguiente:
Para obtener carbono y oxígeno a partir de dióxido de carbono, tendré que invertir 393,5 [kJ/mol]. O, escrito acorde a una ecuación química:
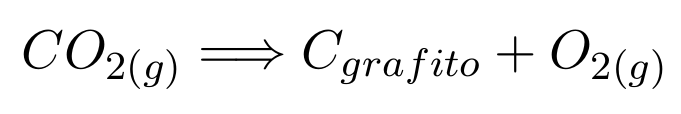
Y este proceso consumiría esa cantidad de energía por mol.
En un solo enunciado, podríamos decir que "El cambio de entalpía para una reacción tiene la misma magnitud, pero un signo distinto para la reacción opuesta", a este enunciado lo llamaremos ley de Lavoisier-Laplace y la podemos observar representada en el siguiente gráfico:
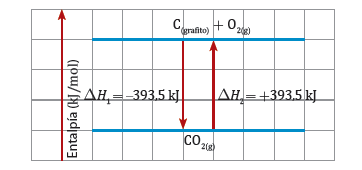
Diagramas entálpicos
De acuerdo a lo ya visto, entonces podremos observar que requerimos expresar dos condiciones posibles:
La entalpía del sistema disminuye, o
La entalpía del sistema aumenta.
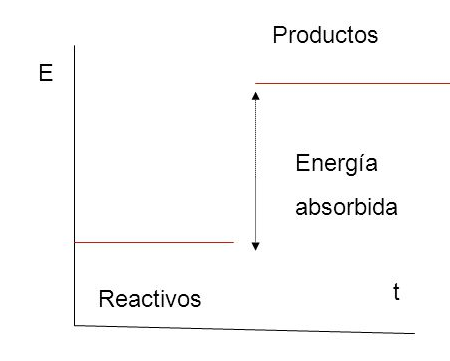
Siguiendo la ecuación de función de estado, podríamos expresar los siguientes gráficos:

Cuando los productos tienen menor entalpía que los reactantes, significa que liberan calor al medio, por lo que las llamamos reacciones exotérmicas.
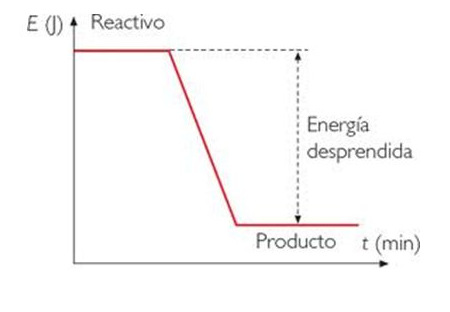
Cuando los productos tienen mayor entalpía que los reactantes, significa que absorbe calor desde el medio, por lo que las llamamos reacciones endotérmicas.