Unidad 1, Clase 5: Ley de Hess
Autor: Camilo Meza Gaete
Contacto: [email protected]
Biografía
Germain Henri Hess
Se graduó como médico, pero se interesó por la química llegando a ser profesor del Instituto Tecnológico de la Universidad de San Petersburgo, formulando posteriormente la Ley de Hess, uno de los primeros principios de la termoquímica.

Enunciados de la ley de Hess
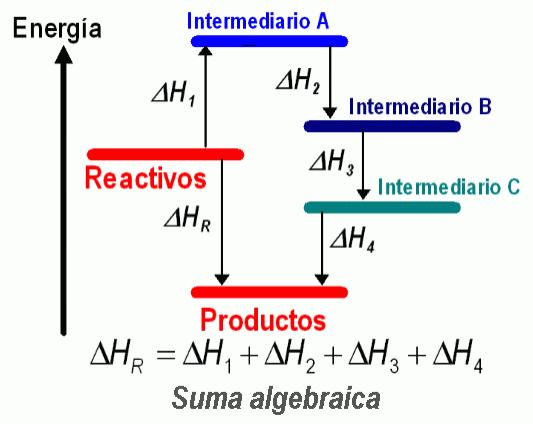
La ley de Hess establece que:
"…la entalpía de una reacción se podía obtener sumando algebraicamente las entalpías de otras reacciones varias relacionadas con la que nos interesa."
Veamos un ejemplo:
El carbono en forma de grafito puede oxidarse hasta dióxido (en la ecuación 1) o monóxido de carbono (en la ecuación 2). Por otro lado, el monóxido de carbono puede oxidarse hasta dióxido de carbono (según la ecuación 3).
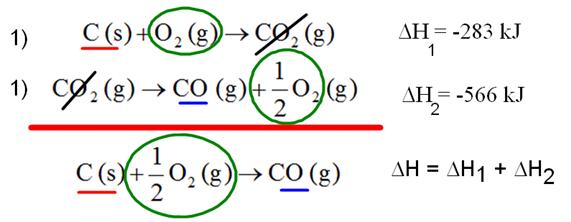
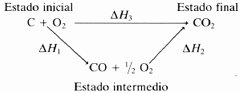
Como se ve a continuación, la suma de las entalpías de la reacción en dos pasos (2)+(3) es igual a la entalpía de la reacción en un paso (1). Lo que se puede esquematizar de la siguiente forma:
Aplicación de la ley de Hess
La ley de Hess se utiliza para deducir el cambio de entalpía en una reacción ΔHr , si se puede escribir esta reacción como un paso intermedio de una reacción más compleja y siempre que se conozcan los cambios de entalpía de la reacción global y de otros pasos.
La suma de ecuaciones químicas parciales lleva a la ecuación de la reacción global.
Si la energía se incluye para cada ecuación y es sumada, el resultado será la energía para la ecuación global.
Este procedimiento se apoya en que los calores de reacción para un gran número de reacciones ya han sido tabulados, incluyendo la formación a partir de sus elementos constituyentes de buena parte de las sustancias químicas conocidas.