Unidad 1, Clase 6: Energía de enlace
Autor: Camilo Meza Gaete
Contacto: [email protected]
Energía de enlace
Una reacción química consiste en un nuevo reagrupamiento de los átomos de los reactivos para formar los productos.
Esto supone la ruptura de ciertos enlaces y la formación de otros nuevos.
Si se conociesen las energías de estos enlaces, se podría calcular fácilmente la entalpía de reacción.
Lo ilustraremos de la siguiente manera:
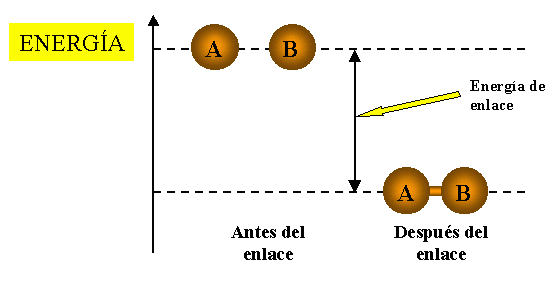
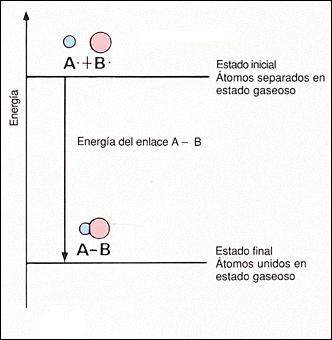
Energía de enlace:
Se llama energía de enlace a la energía necesaria para romper un mol de dichos enlaces.
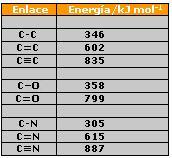
Tabla de energías de enlace:
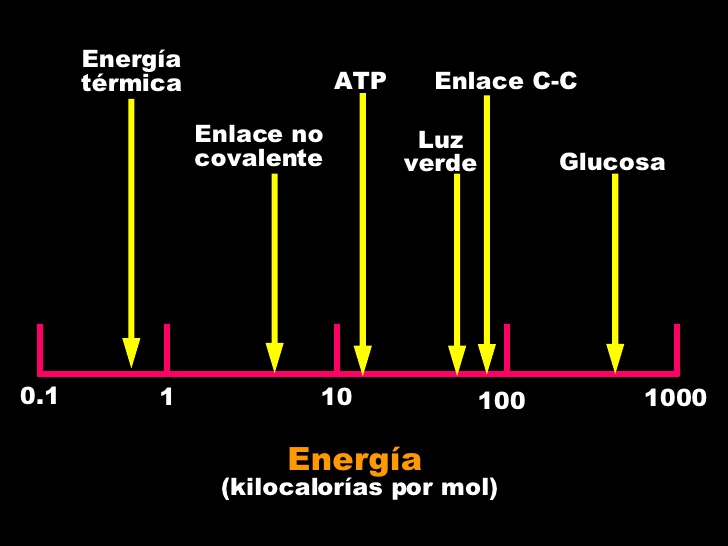
Comparación de energías de enlace:
Así, por ejemplo, la energía del enlace hidrógeno - cloro es la correspondiente a la reacción:
HCl(g) -> H(g) + Cl(g)
de donde resulta que su valor será de 431 [kJ/mol]. Cuanto más elevada sea la energía de enlace, más fuerte y más estable será dicho enlace.
A partir de las energías medias de enlace pueden calcularse, aproximadamente, las entalpías de reacción entre sustancias gaseosas.
Teniendo en cuenta que para la ruptura de enlaces hay que suministrar energía, mientras que al formarse nuevos enlaces se desprende energía, se deduce que:
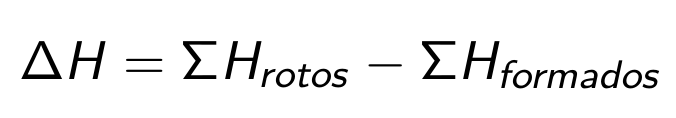
Utilidad
Cuando no se puede aplicar la Ley de Hess, se acude a las energías de enlace para calcular la entalpía de reacción.